Test expert d'activation des monocytes pour les formulations parentérales
Les techniques évolutives de test pyrogénique ont été pleinement adaptées par les pharmacopées. Depuis le 1er juillet 2025, de nombreuses autorités réglementaires exigent des entreprises pharmaceutiques qu'elles adoptent le test d'activation des monocytes (MAT) à la place du test pyrogénique sur lapin (RPT) pour tout nouveau produit parentéral. Ce changement, motivé par des impératifs réglementaires, éthiques et scientifiques, impose de nouvelles exigences aux équipes chargées de la qualité et aux opérations de fabrication.
Vous avez besoin d'une méthode validée et précise pour tester les produits injectables, qui garantisse la sécurité des patients et évite de recourir à des tests in vivo. Vous avez également besoin d'un partenaire qui vous aide à éviter des investissements coûteux en infrastructure, à gérer les évaluations des risques et à surmonter les obstacles techniques tels que les tests d'interférence, les effets de masquage de la faible récupération des endotoxines (LER) et la détection des pyrogènes non endotoxiques (NEP).
Le réseau de laboratoires Eurofins BioPharma Product Testing (BPT) fournit des services MAT complets qui répondent à tous ces défis.

Eurofins BPT aide ses clients à se conformer aux directives actuelles de la pharmacopée :
- Ph. Eur. 2.6.30 et 2.6.40 (Europe)
- USP <151> (États-Unis), autorisant des alternatives in vitro validées au RPT
- JP G4-13-190 (Japon)
- IP 8e édition (Inde)
- Directive CHP 9301 (Chine)
Nos experts surveillent en permanence les mises à jour réglementaires afin de garantir que les tests sont effectués conformément aux exigences actuelles. Nous effectuons également les évaluations des risques requises par les directives européennes lorsque les produits ou les processus changent, en particulier pour confirmer l'absence de NEP indétectables par le lysat d'amébocytes de Lumulus (LAL).
Barrières techniques

Bien que la MAT fournisse des résultats semi-quantitatifs et soit une approche plus acceptable sur le plan éthique que la RPT, elle nécessite une validation spécifique au produit, qui comprend :
- Des études d'interférence et comparatives
- Des contrôles de compatibilité pour les produits qui affectent les systèmes de détection
Des stratégies de démasquage personnalisées pour la récupération à faible endotoxine (LER).
Nos spécialistes, en collaboration avec notre équipe de laboratoire régulièrement formée et expérimentée dans le traitement d'une grande variété de types d'échantillons, sélectionneront le kit MAT le mieux adapté à vos besoins, vous évitant ainsi d'avoir à internaliser les systèmes MAT ou à investir dans la formation d'équipes internes.
Assistance complète

- Consultation réglementaire et sélection des kits MAT
- Conception d'études sur mesure
- Accès à des lecteurs de plaques multimodes compatibles avec la plupart des kits MAT
- Manipulation et stockage sécurisés des cellules primaires et des lignées cellulaires
- Logiciel conforme à la norme 21 CFR Part 11 pour garantir le respect des exigences en matière d'intégrité des données
Services MAT

- Tests de libération par lots
- Détection des NEP en phase finale de développement
- Études LER - requises pour les produits pharmaceutiques biologiques (produits à base de protéines, vaccins et thérapies géniques) contenant une combinaison d'un tensioactif (par exemple, le polysorbate) et d'un chélateur (par exemple, l'EDTA, le citrate). Les études LER sont également requises par la FDA pour les demandes d'autorisation de mise sur le marché de produits biologiques (BLA).
- Études de démasquage pour les produits biologiques
- Méthode alternative de test des endotoxines lorsque le LAL ou le facteur C recombinant (rFC) sont insuffisants
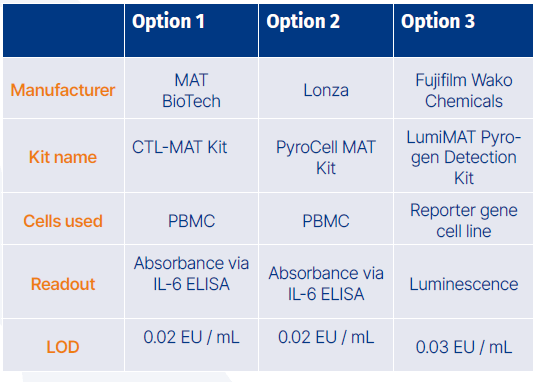
Kits MAT établis

Eurofins BPT vous propose des tests pyrogènes sans compromis : éthiques, précis et vous permettant de répondre aux exigences de conformité.